Une lecture intégrée des réponses végétales aux contraintes du temps par Véronique Mure, botaniste
En hommage à mon ami Francis Hallé
Penser le vivant à partir de ses rythmes biologiques
Le lien entre le climat et l’expression des rythmes biologiques des plantes est depuis longtemps au centre de toutes les attentions. L’alternance des phases de croissance et de repos, leur synchronisation plus ou moins étroite avec les saisons, ainsi que la temporalité de la reproduction, de l’induction florale à la maturité des fruits, constituent une dimension souvent implicite de ces relations, dont l’étude relève de la phénologie[1]. Le terme vient du grec « phainen » / paraître et « logos » / étude. C’est donc l’étude de ce qui est apparent.
Bien avant d’être nommée, considérée comme une science, vers la fin du XIX siècle, la phénologie se trouvait dans les cahiers des jardiniers et des naturalistes. Aussi loin que remontent les écrits on peut lire des témoignages de l’intérêt que portaient les civilisations anciennes au déroulement cyclique de la vie des plantes. Ils en tiraient des enseignements qu’ils dispensaient sous forme de dicton. Les dictons météorologiques, nés des connaissances empiriques du monde rural, basées sur l’observation du ciel, l’aspect des nuages, le sens du vent, les floraisons ou la maturation des fruits constituaient une mémoire collective qui, jusqu’à la fin du 19e siècle, fut un des seuls outils de prévisions dont disposait le monde agricole. Ainsi savait-on en Grèce Antique qu’il fallait « Sèmer quand la grue émigre en Lybie » et plus près de nous qu’à la « Sainte Catherine tout bois prend racine » et que « fleur de prunier trop pressée, récolte menacée » ? A noter que de 1880 à 1945, en France, les stations météo relevaient aussi les dates de retour des oiseaux migrateurs et la floraison des lilas (MURE, 2013).
Dans le contexte climatique actuel, notre attention se concentre sur quelques indicateurs privilégiés, tels la mise à fleur et la feuillaison. Tous les ans, chacun de nous est dans l’attente du premier amandier en fleur ou du premier iris, tout comme il note le débourrement précoce des arbres, floraisons automnales des lilas, des arbres de Judée ou des aubépines. Ces indices temporels constituent autant de repères pour appréhender le cycle des saisons et ses éventuels « dérèglements ». Cependant, si voir des plantes fleurir « hors saison » étonne, ce phénomène n’a rien de nouveau, c’est même un thème récurrent dans les traditions orales aussi bien que dans les récits hagiographiques. Les jardiniers savent depuis toujours que « si l’arbre, en automne, fleurit une seconde fois, jusqu’en mai prochain durera le froid » (HALLE et al., 2008).
Or, ces manifestations apparentes, notamment leur précocité, ne rendent compte que partiellement des transformations à l’œuvre. On sait aujourd’hui que les cycles de vie des plantes se caractérisent aussi par des rythmes biologiques hérités, lentement élaborés et profondément inscrits dans leur organisation. De la germination à la mort, rappelle le botaniste Daniel Barthélémy, le développement d’une plante s’exprime comme une suite régulière et ordonnée de fonctionnements méristématiques, inscrits dans une séquence précise d’événements. À chaque étape de cette séquence, de nouveaux caractères morphologiques et physiologiques émergent tandis que d’autres s’estompent progressivement, si bien que la croissance végétale peut être comprise comme l’expression d’un véritable « mouvement morphogénétique », au sens défini par Nozeran (1978) (BARTHELEMY, 1988).
La question centrale devient alors, jusqu’où les plantes peuvent-elles ajuster leur temporalité biologique à un climat qui ne correspond plus à celui dans lequel leurs rythmes se sont construits au fils du temps ?
Les travaux menés à Montpellier entre le début des années 1980 et les années 2000, portant sur les flores méditerranéennes d’une part et sur les arbres changés d’hémisphère d’autre part, sont ici mobilisés pour tenter d’éclairer cette dimension temporelle du vivant à l’aune des changements climatiques.
Les garrigues méditerranéennes : des rythmes « construits » par la contrainte
Dans les années 1980, le CEFE-CNRS a conduit une étude consacrée aux cycles biologiques de la flore des garrigues du Languedoc, inscrite dans un programme plus large portant sur l’ensemble des régions du monde à climat méditerranéen. Soixante-seize espèces des garrigues montpelliéraines ont fait l’objet d’observations normalisées, avec une périodicité approximative d’un mois. Les résultats portant sur plusieurs années ont mis en évidence que les cycles biologiques ne se contentent pas de subir les contraintes climatiques, mais s’y organisent profondément. La sécheresse estivale, associée à des températures élevées et à une forte variabilité interannuelle, structure l’ensemble du cycle annuel avec repos estival marqué, reprise automnale, croissance hivernale discrète et opportuniste (FLORET 1984 & 1989).
Des inventaires récents portant sur 496 espèces d’arbres et 147 sous-espèces méditerranéennes, consolident les observations phénologiques en les quantifiant (EFI, 2025). La prépondérance des feuillages persistants yreprésente environ 60 à 75 % des essences arborées. C’est certainement la caractéristique la plus directement perceptible de la flore méditerranéenne, dominée par des stratégies sclérophylles favorisant la limitation des pertes hydriques. Chênes verts (Quercus ilex), pins d’Alep (Pinus halepensis), arbousiers (Arbutus unedo), pistachiers lentisque (Pistacia lentiscus), filaires (Phillyrea sp.), nerpruns (Ramnus alaternus) et bien d’autres façonnent ces paysages toujours verts propre au midi. L’érable de Montpellier (Acer monspessulanum), le pistachier térébinthe (Pistacia terebinthus) tous deux caducifoliés, ou encore le chêne blanc (Quercus pubescens) marcescent, figurent, quant-à-eux, parmi les 25 % d’espèces faisant exception à cette tendance. Sur le plan reproductif, la floraison printanière constitue le mode dominant, concernant 55 à 70 % des espèces, généralement initiée dès la fin de l’hiver, période correspondant à une disponibilité optimale en eau et à des conditions thermiques modérées. À l’inverse, la floraison estivale demeure minoritaire(10 à 20 %des essences), traduisant une stratégie plus contraignante dans un contexte de stress hydrique maximal. On peut citer dans cette catégorie le buplèvre ligneux (Bupleurum fruticosum) dont les fleurs discrètes, mais néanmoins abondantes, font le régal des insectes au cœur de l’été. Un pourcentage significatif d’espèces(15 à 25 %) présente une floraison automnale ou tardo-estivale, dont le spectaculaire arbousier (Arbutus unedo) qui synchronise floraison et maturité de ces grosses baies rouges, au grand étonnement des botanistes en herbe peu habitués à voir des fleurs et des fruits en même temps sur un arbre.
Cette distribution saisonnière des floraisons, combinée à la forte proportion d’espèces à feuillage persistant, constituent un marqueur fonctionnel majeur des écosystèmes méditerranéens. Elles relèvent d’une intégration évolutive des contraintes climatiques dans l’architecture, la morphogenèse et la physiologie des plantes.
Déplacement géographique et ajustement phénologique
A ce stade, un second niveau d’analyse est introduit avec une étude menée en 1983 au sein du Laboratoire de Botanique tropicale dirigé par le Professeur Francis Hallé à l’Institut de Botanique de Montpellier. Cette recherche, consacrée à la phénologie de dix-huit arbres fruitiers et ornementaux transplantés hors de leur aire d’origine, notamment en changeant d’hémisphère, repose sur l’hypothèse qu’un déplacement géographique rapide soumet les plantes à une modification brutale de leur régime climatique, constituant une mise à l’épreuve directe et sans transition de leurs rythmes biologiques (MURE, 1986).
Cette enquête révèle que la répartition des 18 essences le long d’un gradient de latitudes est d’autant plus large que leur phénologie est labile et, par ailleurs, que la majorité d’entre elles décale de six mois le déroulement de ses cycles phénologiques, entre hémisphères Nord et Sud. C’est le cas, par exemple, du mimosa (Acacia dealbata) qui fleurit en janvier-février dans nos jardins mais aussi au cours de l’hiver en Australie avec un pic de floraison en août. A noter que le décalage est d’autant plus marqué que la saisonnalité est forte à la latitude considérée. Bien que portant sur un nombre limité d’espèces et d’individus, ainsi que sur des événements phénologiques isolés plus que sur les rythmes biologiques dans leur ensemble, ce travail met en évidence que l’ajustement des dates de floraison ou de feuillaison ne signifie pas nécessairement une reprogrammation complète du cycle annuel.
Conservation ou abandon des rythmes
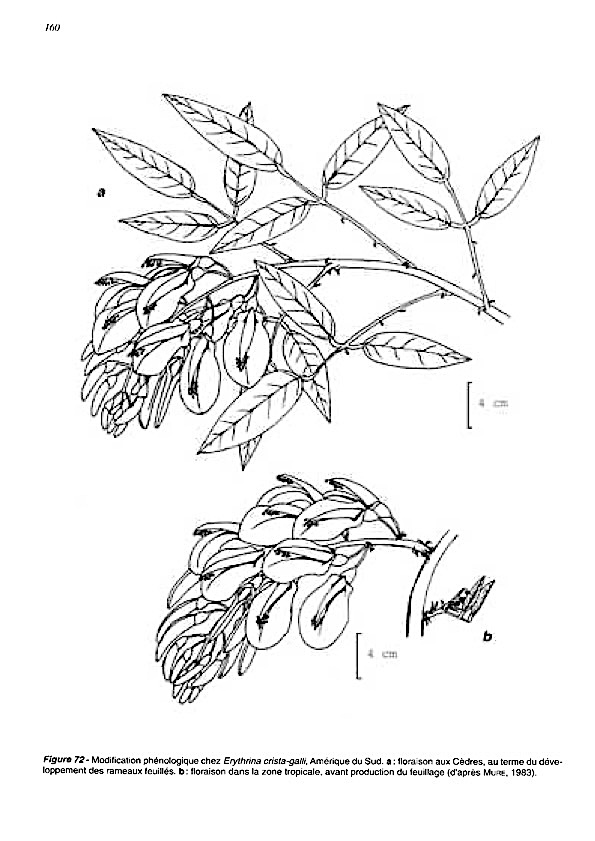
En 2002 une étude du professeur Francis Hallé et de ses collègues consolide cette intuition à partir de l’observation de plantes originaires de l’hémisphère austral cultivées au jardin botanique des Cèdres sur la Côte d’Azur (HALLE et al., 2002).
Certaines plantes australiennes ou sud-africaines modifient leur calendrier phénologique et adoptent un rythme boréal, caractérisé par une floraison et une croissance synchronisées avec les saisons locales. Outre l’Acacia dealbata déjà évoqué, ce comportement concerne surtout des plantes géophytes ou à cycles courts, pour lesquelles la dissociation entre croissance végétative et reproduction est moins rigide.
Chez les plantes bulbeuses d’Afrique du Sud, plusieurs espèces à feuillage persistant — Agapanthus, Clivia, Crinum, Ledebouria socialis, Drimiopsis maculata, Ornithogalum caudatum — fleurissent au printemps ou au début de l’été aux Cèdres, abandonnant ainsi le calendrier austral. Toutefois, ces floraisons sont souvent longues et plastiques, s’étendant sur plusieurs mois et pouvant déborder d’une saison à l’autre selon les années.
Des espèces, comme Tulbaghia violacea, Eucomis ou Galtonia, présentent un comportement intermédiaire : la floraison peut se produire tantôt au printemps-été, tantôt à l’automne, sans stabilité interannuelle stricte. Ces espèces n’illustrent pas une inversion nette, mais plutôt une plasticité phénologique élevée, compatible avec plusieurs fenêtres saisonnières.
Il est important de souligner que ces comportements ne constituent pas un groupe homogène. La variabilité intra-spécifique et interannuelle est forte, ce qui empêche toute classification rigide.
Par ailleurs, pour de nombreuses plantes originaires de l’hémisphère austral cultivées sous climat méditerranéen boréal, les observations montrent ici une conservation globale du rythme biologique originel, malgré l’inversion des saisons. A titre d’exemple, parmi les Asteraceae sud-africaines, les périodes de floraison observées dans la région d’origine se retrouvent, avec des décalages limités, sur la Côte d’Azur. Senecio angulatus fleurit en janvier aussi bien en Afrique du Sud qu’à Cap-Ferrat, ce qui conduit cette espèce à fleurir en plein hiver en Europe comme en plein été dans son aire d’origine.
La conservation du rythme concerne également les cycles foliaires. Les Brachychiton australiens (B. acerifolius, B. discolor), arbres caducifoliés synchronisés avec l’alternance saison sèche/saison humide dans leur aire d’origine, perdent leurs feuilles en été aux Cèdres, c’est-à-dire durant l’été boréal correspondant à l’hiver austral sec. La chute des feuilles reste ici étroitement corrélée à la floraison, montrant une conservation de l’enchaînement des phases du cycle, sans pour autant se caractériser par une rigidité absolue des dates.
Ces exemples montrent que l’expression des rythmes phénologiques ne dépend pas du seul régime thermique local, mais qu’elle est également gouvernée par la photopériode et par une organisation morphogénétique héritée. Ils mettent en évidence la coexistence de ces deux niveaux de contrôle temporel, d’une part, une phénologie plastique, sensible aux variations environnementales, et, d’autre part, un rythme biologique profond, inscrit dans l’architecture et la morphogenèse des plantes, beaucoup plus lent à se transformer. Ainsi, l’ajustement des dates phénologiques ne correspond pas nécessairement à une reprogrammation complète du cycle annuel et des décalages persistants peuvent subsister entre le rythme hérité et le climat d’accueil.
Les tendances observées à l’échelle de certains taxons (Asteraceae, Proteaceae, Iridaceae) restent fragiles et souvent contredites à l’échelle spécifique. Cependant, ce que révèlent essentiellement ces travaux, c’est la diversité des réponses temporelles du vivant et la nécessité de considérer les rythmes biologiques comme une dimension centrale de l’adaptation des plantes.
Se dessine l’idée que la phénologie observable ne suffit pas à rendre compte de la temporalité profonde des plantes.
Le lierre (Hedera helix) offre un exemple particulièrement éclairant de la dissociation entre climat local et rythme biologique hérité. Seul représentant spontané en Europe tempérée d’une famille majoritairement tropicale, les Araliacées, il conserve une organisation rythmique singulière, marquée par une floraison automnale et hivernale. Cette temporalité reproductive, atypique chez les ligneux tempérés, ne relève ni d’une anomalie ni d’un effet récent du réchauffement climatique, mais de la persistance d’un rythme ancien, peu dépendant de la saisonnalité thermique. Chez le lierre, la floraison tardive s’inscrit dans une stratégie cohérente à l’échelle du cycle annuel, avec un investissement reproducteur différé après la phase de croissance. Elle illustre la distinction entre phénologie ajustable et rythme biologique profond, et montre que certaines floraisons hivernales traduisent moins une désynchronisation contemporaine qu’une temporalité héritée rendue plus visible par l’atténuation des contraintes climatiques.
Le changement climatique comme délocalisation in-situ
Mises en perspective, toutes ces observations invitent à dépasser une lecture strictement « thermique » des évènements phénologiques. Les changements climatiques à l’œuvre n’induisent pas seulement des avancées de dates de floraison ou de feuillaison, ils placent les plantes dans des régimes climatiques nouveaux, leur faisant subir une « délocalisation » climatique sans déplacement géographique.
À l’instar des plantes transplantées hors de leur aire d’origine, de nombreux arbres indigènes se trouvent désormais confrontés à un climat qui n’est plus celui dans lequel leur rythme biologique s’est historiquement construit.
Le changement s’opère désormais in situ et concerne, à des degrés divers, l’ensemble des végétations sous climats à saisonnalité marquée.
Désynchronisations et tensions rythmiques
Ces phénomènes sont aujourd’hui bien documentés et ont été intégrés dans des modèles prédictifs fondés sur l’accumulation de degrés-jours. Les observations phénologiques collectées depuis plusieurs dizaines d’années en arboriculture fruitière ou en viticulture, mettent en lumière une avance généralisée des stades printaniers chez de nombreuses espèces ligneuses tempérées, souvent de l’ordre de plusieurs jours par décennie. Le débourrement des bourgeons arrive plus tôt au printemps, accompagné d’une avancée des périodes de floraison, de maturité des fruits et avancement des récoltes. La date moyenne des vendanges a avancé de 18 jours entre la décennie 1965-1974 et la décennie 2010-2019. Les périodes de végétation commençant plus tôt et se terminant également plus tard, c’est ainsi l’ensemble de la saison végétative qui est allongée. On considère que du fait des changements climatiques c’est 3 semaines de durée de végétation supplémentaires qui ont été gagnées en 50 ans !
Cette situation engendre des états de désynchronisation chronique. Les floraisons précoces observées sous climat modifié peuvent se produire malgré des besoins en froid hivernal insuffisamment satisfaits, des risques accrus de gel tardif ou des décalages avec les cycles des pollinisateurs. Ces dysfonctionnements ne relèvent pas uniquement d’un stress climatique ponctuel, mais traduisent une tension entre phénologie ajustée et rythme fondamental conservé.
Le chêne vert (Quercus ilex) : un exemple de rythmes confrontés aux changements climatiques
Le chêne vert, ou yeuse (Quercus ilex L.), constitue un exemple particulièrement éclairant pour interroger, à l’échelle d’une espèce, la question des rythmes biologiques face aux transformations climatiques actuelles. Essence méditerranéenne par excellence, dominante des communautés végétales du Quercion ilicis, l’yeuse incarne un état d’adéquation ancienne entre climat, architecture végétale et cycle biologique.
Les travaux de Floret et al. (1984 & 1989) ont montré que le cycle biologique du chêne vert est profondément structuré par les contraintes du climat méditerranéen.
Arbre à feuilles persistantes pouvant atteindre 15 m de haut, phanérophyte, amentale. Les bourgeons floraux et les fleurs apparaissent sur les nouvelles pousses allongées. Les chatons mâles apparaissent dans la partie inférieure des branches et les fleurs femelles au-dessus. Feuilles sclérophylles, oblongues-ovales, d’environ 4 cm de long et 2 cm de large. A noter un dimorphisme foliaire marqué, associant des feuilles des parties inférieures de l’arbre souvent dentées ou épineuses alors qu’elles sont entières, coriaces et sclérophylles dans les parties hautes, traduisant une stratégie adaptative de protection face à l’herbivorie.
Croissance végétative d’avril à mai. Pendant cette période, l’élongation a lieu dans toute la canopée. Il y a cependant des vagues de croissance supplémentaires plus tard dans la saison, lorsqu’une partie des branches, principalement dans la partie supérieure de la canopée, poussent et s’allongent. Le nombre et le moment de ces vagues de croissance varient considérablement d’un arbre à l’autre et d’un endroit à l’autre. Elles peuvent durer jusqu’aux pluies d’automne, généralement en août et septembre.
Les boutons floraux et les fleurs apparaissent en mai ; la nouaison a lieu de mai à novembre et la chute des glands (akènes) de novembre à janvier. La pollinisation est anémogame et la dissémination des fruits syn-zoochore.
La chute des feuilles de la partie inférieure des nouvelles branches se produit en mai. Elles ne durent donc que 1 à 2 mois. Cependant, la plupart des feuilles tombent au cours de leur troisième année, soit en mai, soit entre septembre et décembre. Il est difficile cependant de déterminer une durée de vie des feuilles à partir de l’observation des pousses puisqu’il y a plusieurs pousses par an et que ce nombre de pousses ne parait pas constant.
Le système racinaire pivotant et vigoureux constitue l’un des fondements de sa résilience face aux perturbations récurrentes qu’il a subi pendant des siècles, en particulier le feu et la coupe. L’arbre rejette vigoureusement de souche après incendie ou exploitation, assurant une régénération rapide des parties aériennes. Jusqu’à l’arrivée du pétrole, son bois dense, à fort pouvoir calorifique, fut très recherché pour le chauffage domestique, l’alimentation des fours de la boulange et des petites industries locales tout comme pour la production de charbon de bois.
Sur le plan morphologique et fonctionnel, le chêne vert présente un ensemble de traits convergents vers la résistance aux contraintes hydriques : feuilles sclérophylles à face inférieure tomenteuse, port trapu, système racinaire pivotant profond, faible vulnérabilité à la cavitation et à l’embolie du xylème (COCHARD & al., 1992). Ces caractéristiques confèrent à l’espèce une remarquable tolérance à la sécheresse estivale, faisant du chêne vert l’un des chênes méditerranéens les plus résistants au stress hydrique.
Dans ce contexte, cette essence apparaissait jusqu’à assez récemment comme un exemple abouti de ce que l’on pouvait qualifier, à la suite de Floret et al. (1984), de rythme biologique stabilisé. Il ne s’agit pas d’une simple plasticité phénologique, mais d’une intégration profonde des contraintes climatiques dans l’architecture, la physiologie et la temporalité du développement. La chênaie méditerranéenne constituait classiquement le stade mature de la série écologique, pouvant ainsi être comprise comme un système où le temps biologique s’est lentement accordé au climat.
Or, le changement climatique en cours place aujourd’hui le chêne vert dans une configuration nouvelle. Non plus celle d’une espèce déplacée vers un autre climat, mais plutôt celle d’une espèce confrontée à un nouveau climat in situ.
Si le chêne vert demeure une essence clé des paysages méditerranéens, son état sanitaire en 2025 montre des signes de dégradation et sa dynamique de régénération est menacée localement par l’augmentation du stress hydrique, les vagues de chaleur et l’aggravation des risques feux et biotiques tout comme de sa sensibilité à divers pathogènes (IGN, 2025). On peut donc s’attendre à un remodelage progressif de sa présence sur les stations les plus contraignantes. D’autant que les modélisations bioclimatiques montrent que la zone méditerranéenne pourrait être soumise à un climat beaucoup plus sec qui ne correspond à rien de connu actuellement sur le territoire métropolitain. Faute de données, il est impossible d’estimer l’avenir du chêne vert dans les zones où on le connaît actuellement(BADEAU & al., 2007). Ces modélisations suggèrent par ailleurs un élargissement de la niche climatique potentielle du chêne vert bien au-delà de son aire méditerranéenne actuelle, dans des régions aujourd’hui tempérées, allant jusqu’à la côte ouest tout en dépassant la latitude de la Loire à l’horizon 2100. À court terme, le chêne vert apparaît ainsi comme un « gagnant » relatif du réchauffement climatique (sauf en région méditerranéenne), suscitant un intérêt croissant de la part des forestiers pour des contextes de sols secs ou pauvres.
Cependant, cette lecture strictement bioclimatique ne suffit pas à épuiser la question. À la lumière des travaux de Hallé et al. (2002) sur la conservation ou l’abandon des rythmes saisonniers, il convient de distinguer l’aptitude d’une espèce à occuper un espace climatique donné de sa capacité à y réorganiser durablement son rythme biologique. Le chêne vert est porteur d’un rythme méditerranéen profondément inscrit, caractérisé notamment par l’importance du repos estival et par une croissance opportuniste liée aux pluies. Son installation dans des régions à saisonnalité différente, ou soumises à une variabilité accrue des événements extrêmes (gels tardifs, sécheresses printanières), pourrait générer des décalages encore mal appréhendés entre phénologie observable, fonctionnement hydraulique et dynamique de reproduction.
Ainsi, le chêne vert occupe une position singulière dans la réflexion prospective : il n’est ni une espèce strictement vulnérable, ni un simple modèle de résilience généralisable. Il incarne plutôt une forme de convergence entre les flores méditerranéennes anciennes et les flores tempérées en cours de « méditerranéisation ». En ce sens, les garrigues, longtemps perçue comme un système dégradé ou marginal, apparaissent rétrospectivement comme un laboratoire écologique anticipateur, offrant des clés de lecture pour comprendre les transformations actuelles des paysages forestiers.
L’avenir du chêne vert à court terme se jouera donc moins dans sa capacité à avancer ses dates de croissance ou de floraison que dans la compatibilité de son rythme biologique hérité avec un climat qui lui devient étranger, mettant à l’épreuve non seulement sa tolérance physiologique, mais la cohérence avec ces temporalités internes. À travers le chêne vert, c’est ainsi toute la question de l’avenir des rythmes du vivant en contexte de transition climatique qui se trouve posée.
Être indigène ne suffit plus : vers une biodiversité fonctionnelle et temporelle
Dans ce contexte, les catégories classiques d’espèces « indigènes » ou « exotiques » montrent de fait leurs limites. Une espèce « locale » mais phénologiquement désynchronisée, contribue moins efficacement aux réseaux trophiques qu’une espèce introduite mais temporellement compatible avec les périodes d’activité des pollinisateurs, comme le montre un inventaire des abeilles sauvages sur le territoire du Parc national de Port-Cros mené par Gombault et al. (2018). Cette étude établie que les espèces exotiques cultivées du jardin de Port-Cros peuvent constituer d’importantes ressources pour les abeilles. Certaines des espèces originaires d’Afrique du Sud ou d’Amérique du Sud sont mieux adaptées que des espèces locales à des conditions climatiques exceptionnelles. Ainsi, en 2017, elles ont pu fournir du nectar aux insectes alors que dans les mêmes conditions, les espèces locales présentaient une phénologie ralentie ou perturbée, avec notamment des floraisons écourtées et peu abondantes (GOMBAULT et al. 2018).
La synchronisation de la production de nectar et de pollen, ou de fruits, avec les besoins des insectes et des oiseaux, dépend, dans ce cas, plus de l’expression des rythmes biologiques que de l’origine biogéographique. Penser la biodiversité à l’aune du changement climatique implique d’intégrer une dimension temporelle et fonctionnelle, au-delà des seules catégories spatiales.
Vers une écologie du temps
Pris ensemble, les travaux de Floret et al. (1984), Mure (1986) et Hallé et al. (2002) montrent que les réponses des plantes aux changements climatiques ne peuvent être comprises sans intégrer la profondeur temporelle du vivant. La phénologie n’est que la partie émergée d’un système rythmique plus vaste, partiellement plastique mais jamais totalement reconfigurable à court terme.
Dans ce cadre, les changements en cours ne sauraient être interprétés uniquement comme un facteur d’avance phénologique généralisée. Ils s’apparentent davantage à une délocalisation climatique silencieuse, dans laquelle les espèces demeurent géographiquement en place tout en étant confrontées à une modification rapide des conditions climatiques qui avaient présidé à la construction de leur rythme biologique. Comme dans les situations de transplantation analysées précédemment, l’ajustement phénologique peut être réel, du fait de la plasticité de certaines espèces, mais il révèle aussi des désajustements persistants entre climat subit et temporalités héritées.
On l’a vu, les réponses des plantes à de nouvelles contraintes climatiques ne relèvent ni d’une simple plasticité phénologique immédiate, ni d’une rigidité absolue des cycles biologiques, mais d’un continuum de réponses, où se combinent ajustements superficiels et inerties profondes.
Penser l’avenir des végétations implique ainsi de dépasser les catégories classiques d’espèces indigènes ou exotiques pour intégrer une biodiversité fonctionnelle et temporelle, fondée sur la compatibilité des rythmes biologiques avec les nouveaux régimes climatiques. Le changement climatique apparaît alors comme une crise des rythmes autant que des températures, appelant une écologie pleinement consciente du temps.
Plaidons pour une écologie consciente des ajustements biologiques imposés aujourd’hui aux plantes sur des temps compressés et de leurs limites. Une telle approche, en réconciliant phénologie, architecture des plantes et histoire évolutive des rythmes, ouvre un cadre conceptuel renouvelé pour penser l’avenir des végétations et, au-delà, notre propre relation au vivant dans un climat en transformation rapide.
Résumé
Les réponses des plantes aux changements climatiques sont le plus souvent analysées à travers l’avance des stades phénologiques, notamment la floraison et la feuillaison. Cet article propose d’élargir cette lecture en replaçant la phénologie dans la profondeur des rythmes biologiques hérités, lentement construits et intégrés à l’architecture, à la morphogenèse et à la physiologie des plantes.
À partir de travaux menés entre les années 1980 et le début des années 2000 sur les flores méditerranéennes et sur des plantes ligneuses transplantées hors de leur aire d’origine, notamment entre hémisphères, il met en évidence un continuum de réponses végétales aux contraintes climatiques, allant d’ajustements phénologiques partiels à la conservation de rythmes biologiques profonds.
Ces résultats montrent l’existence de deux niveaux de contrôle temporel : une phénologie relativement plastique et un rythme fondamental, plus lent à se reconfigurer. Le changement climatique est ainsi interprété comme une forme de délocalisation climatique in situ, génératrice de désynchronisations durables. Le cas du chêne vert (Quercus ilex) illustre les tensions actuelles entre rythme stabilisé et nouvelles contraintes climatiques, appelant une écologie pleinement attentive au temps.
Mots-clés phénologie ; rythme biologique ; floraison ; plasticité ; changement climatique ; écosystèmes méditerranéens
Abstract
Plant responses to climate change are commonly assessed through shifts in phenological events, particularly flowering and leaf emergence. This paper proposes a broader perspective by situating phenology within the deeper framework of inherited biological rhythms, progressively shaped over long time scales and embedded in plant architecture, morphogenesis and physiology.
Based on studies conducted from the 1980s to the early 2000s on Mediterranean vegetation and on woody species transplanted outside their native ranges, notably across hemispheres, the paper highlights a continuum of plant responses to climatic constraints, ranging from partial phenological adjustment to the persistence of deeply conserved biological rhythms.
These results point to two levels of temporal control: a relatively plastic phenology and a fundamental rhythm that is far slower to reorganize. Contemporary climate change is therefore interpreted as a form of in situ climatic relocation, generating lasting desynchronizations between inherited rhythms and new climatic regimes. The case of the evergreen oak (Quercus ilex) exemplifies the emerging tensions between stabilized biological rhythms and ongoing climatic change, supporting the need for an ecology explicitly attentive to time.
Keywords: phenology; biological rhythm; flowering; plasticity; climate change; Mediterranean ecosystems
Bibliographie
- Badeau, V., Dupouey, J.-L., Cluzeau, C., Drapier, J., & Le Bas, C. (2007). Aires potentielles de répartition des essences forestières d’ici 2100. Rendez-vous techniques de l’ONF — Hors-série n°3 : Forêts et milieux naturels face aux changements climatiques, pp. 62–66. Office National des Forêts / RDV Techniques (hors-série).
- Barthélémy, D, (1988). Architecture et sexualité chez quelques plantes tropicales : le concept de floraison automatique. Thèse de doctorat : Physiologie, biologie des organismes et des populations : Université des sciences et techniques du Languedoc
- Cochard, H., Bréda, N., Granier, A., & Aussenac, G. (1992). Vulnerability to air embolism of three European oak species (Quercus petraea (Matt.) Liebl., Q. pubescens Willd., Q. robur L.). Annales des Sciences Forestières, 49(3), 225–233. DOI: 10.1051/forest:19920302.
- INRAE – EFI (2025). A complete inventory of all native Mediterranean tree species. Données ouvertes.
- Floret, C., Le Floc’h, E., Orschan, G., & Romane, F. (1984). Contribution à l’étude du cycle biologique de quelques espèces de la garrigue, Bulletin de la Société Botanique de France. Actualités Botaniques, 131:2-4, 451-463, DOI: 10.1080/01811789.1984. 10826684 To link to this article: https://doi.org/10.1080/01811789.1984.10826684
- Floret, C., Galan M.J., Le Floc’h, E., Leprince, F., & Romane, F. (1989) 2.1. France In : Orshan, G., (ed.), Plant Pheno-morphological Studies in Mediterranean Type Ecosystems, pp. 9-97. © 1989 by Kluwer Academic Publishers, Dordrecht — Printed in the Netherlands.
- Gombault, C., Guilbaud, L., Morison, N., & Vaissière, B. (2018). Inventaires des abeilles sauvages sur les sites de Port-Cros, Bagaud et du cap Lardier. Rapport final, INRA, Laboratoire Pollinisation et Écologie des Abeilles (UR 406), Parc national de Port-Cros, 46 p.
- Hallé, F., Excoubeyrou, G., Mure, V., Descoings, B. (2002). Conservation ou abandon du rythme austral. Journal de Botanique de la Société Botanique de France, 18–19, 151–160.
- Hallé F., Lieutaghi P., (2008) Aux origines des plantes, T2, éd. Fayard.
- IGN (2025). Inventaire forestier national – Résultats 2025. Institut national de l’information géographique et forestière, Paris, France. Données issues du dispositif IFN continu.
- Mure, V. (1986). Phénologie de quelques arbres fruitiers et ornementaux transplantés hors de leur aire d’origine. Revue d’Écologie (Terre et Vie), pp. 41-43.
- Mure, V. (2013). Conversations sur l’herbe, Préface Gilles Clément. Ed. Atelier Baie.
- Nozeran, R. (1978) Réflexions sur les enchaînements de fonctionnements au cours du cycle des végétaux supérieurs, Bulletin de la Société Botanique de France, 125:5-6, 263-279, DOI: 10.1080/00378941.1978.10839452
[1] Phénologie : Discipline qui étudie les dates et le déroulement des événements saisonniers du cycle de vie des plantes (débourrement, floraison, fructification, chute des feuilles), ainsi que leurs variations d’une année à l’autre en relation avec les conditions environnementales, en particulier le climat ; Par extension le déroulement des événements saisonniers eux-mêmes.


















Il n'y a pas de commentaires